中国科大揭示Lon蛋白酶在单个蛋白水解位点对底物进行持续切割
2021-12-17 | 查看: 197
Lon蛋白酶是一种高度保守的蛋白酶,存在于细菌、古菌和真核细胞器中。细菌Lon通过降解异常蛋白,在蛋白质稳态的质量控制中发挥着关键作用,同时通过降解应激反应、毒力和群体行为相关的特定调节蛋白,在特定的细胞生理控制中发挥着关键作用。
Lon组装成同源六聚体复合物,每个单体中包括共价连接的N端区域、AAA+(与多种细胞活动相关的ATP酶)域和蛋白酶域。晶体结构表明,AAA+和蛋白酶结构域形成一个封闭的腔室,六个ATP酶位点朝外,六个蛋白水解活性位点朝内。已有研究表明了与共价抑制剂结合的蛋白水解活性位点的结构,然而,与蛋白酶活性位点结合的底物结构尚未确定。
迄今为止,人们致力于了解蛋白质底物如何被AAA+蛋白酶的AAA+环识别、去折叠和移位,张凯铭/张崇毅团队在2021年10月在JBC和Science Advances连续发表两篇文章,阐述了上述相关的研究工作。然而,关于底物在到达蛋白水解室后如何在蛋白水解活性位点水解,我们知之甚少。前人的研究报道了包括Lon在内的几种AAA+蛋白酶降解的蛋白质底物会经历持续性蛋白水解过程,由此蛋白质底物被切割成小肽,而不会释放部分降解的中间体。由寡聚酶形成的“封闭室”曾被提出可以用于隔离蛋白质底物,从而为观察到持续性降解提供了一个直接的解释。
2021年11月10日,中国科学技术大学张凯铭研究组和台北中央研究院张崇毅研究组再次合作在Sciences Advances杂志发表题为“Processive cleavage of substrate at individual proteolytic active sites of the Lon protease complex”的文章。论文解析了Lon复合体和水解底物的结合结构,揭示了Lon蛋白水解的作用机制。

在本次工作中,中科大生医部副研究员李珊珊等人利用结构和生化证据表明上述“封闭室”并不是此前观察到Lon进行持续性降解的直接原因。高分辨率冷冻电子显微镜密度图(2.4 Å)揭示了在每个蛋白水解活性位点上的底物多肽的清晰密度。此外,Lon与底物多肽的晶体结构表明,底物总是通过C末端与Lon结合,而Lon的六个活性位点中的每一个都形成一个狭窄的结合槽,仅容纳底物的非引物残基;并进一步揭示了C-to-N的加工裂解机制。蛋白质降解试验证实,持续性降解发生在单个蛋白水解活性位点水平。此外,研究人员在底物结合槽的出口侧发现了一个以前未被识别的酸性残基;这种保守的非催化残基对持续性裂解活性至关重要,可能通过与裂解中间体的羧基-羧酸酯相互作用促进持续性蛋白水解。总之,这些结果揭示了一种以前未被发现的Lon蛋白酶持续性降解底物的机制。
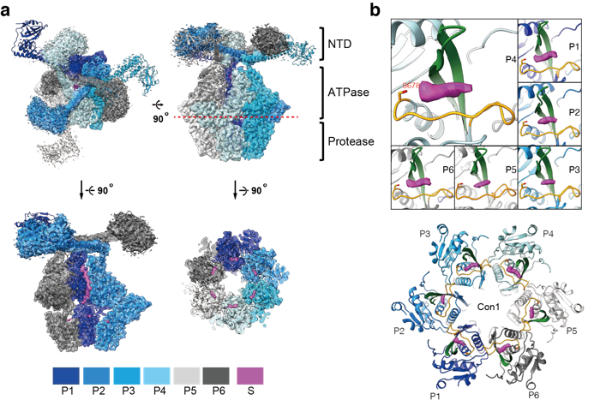
图例:Lon的蛋白水解机制。a.MtaLonA的2.4-Å冷冻电镜结构。b.位于蛋白水解活性位点上的底物多肽冷冻电镜密度(洋红色)。
斯坦福大学Wah Chiu院士为该研究工作提供了宝贵意见。本研究获得了Stanford-SLAC电镜平台、台北中央研究院电镜平台和中国科学技术大学细胞动力学教育部重点实验室及冷冻电镜平台的大力支持。中国科学技术大学为该工作的第一完成单位,生命科学与医学部李珊珊副研究员和台北中央研究院博士后谢侃言为共同第一作者。张凯铭、张崇毅研究员为共同通讯作者。
原文链接:https://www.science.org/doi/10.1126/sciadv.abj9537
(生命科学与医学部、科研部)
